








《高中化学氧化还原反应PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为780 KB,总共有21页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 21页
- 780 KB
- VIP模板
- ppt
- 数字产品不支持退货
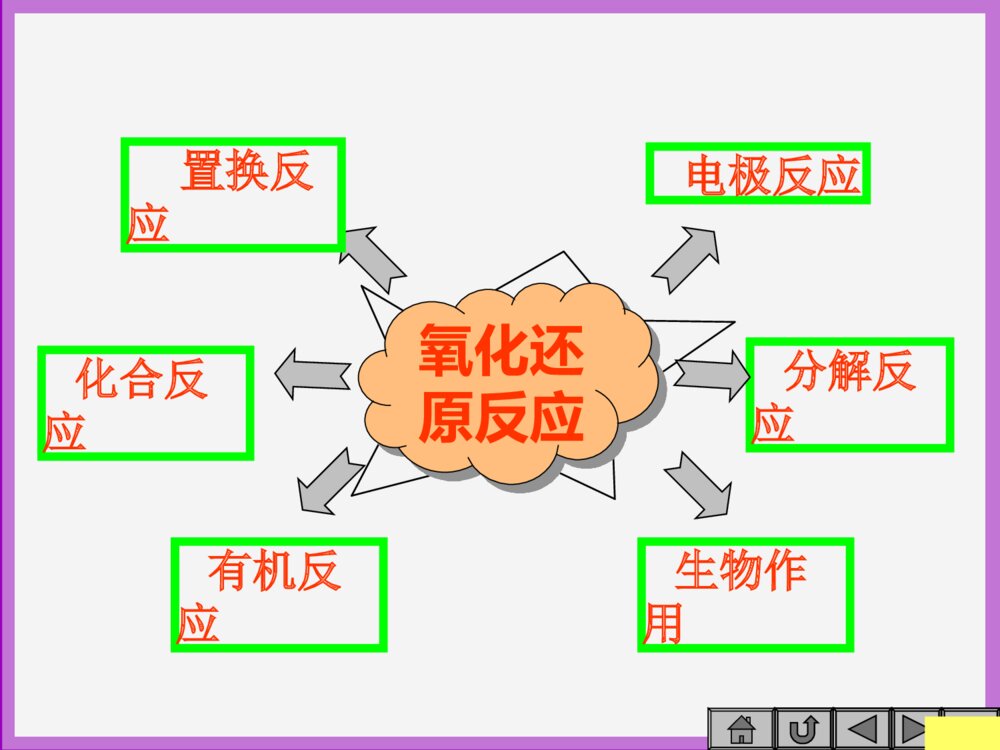
结束结束教学目标强弱判断课堂小结基本概念综合应用反应规律主菜单结束结束氧化还原反应知识目标氧化还原反应知识目标掌握氧化还原反应的实质,氧化还原反应中氧化剂、还原剂的判断。掌握氧化还原反应的一般规律,重点掌握氧化性、还原性的强弱比较。通过复习达到以下目的:通过复习达到以下目的:结束置换反应电极反应化合反应分解反应氧化还原反应返回有机反应生物作用结束一一..基本概念基本概念判断下列哪些反应是氧化还原反应?理由?1. Na2O+H2O=2NaOH2. 2Fe+Al2O3=2Al+Fe2O33. IBr+H2O=HBr+HIO4. CH4+Cl2→CH3Cl+HCl5.NaH+NH3=NaNH2+H2↑光△以5为例判断氧化剂、还原剂、氧化产物、还原产物。还原剂氧化剂氧化产物还原产物+1-1-3+1+1-3+10规律结束反应实质:有电子得失或电子对的偏移。表现特征:元素化合价有升降。一、基本概念一、基本概念反应物氧化剂还原剂发生还原反应(被还原)还原产物生成物(具有氧化性)得电子(化合价降低)(具有还原性)发生氧化反应(被氧化)失电子(化合价升高)氧化产物(具有还原性)(具有氧化性)结束氧化还原反应一般规律之一:氧化还原反应一般规律之一:电子得失守恒—电子得失守恒—化合价有升必有降,化合价有升必有降,化合价升高总数等于化合价降低总数;化合价升高总数等于化合价降低总数;电子有得必有失,失电子总数必等于得电子有得必有失,失电子总数必等于得电子总数。电子总数。实验室在配置FeSO4溶液时总是放入一些铁粉或小铁钉,试用离子反应方程式表示其中的原理。Fe+Fe3+=2Fe2+?Fe+2Fe3+=3Fe2+结束氧化还原反应一般规律之二:氧化还原反应一般规律之二:反应发生条件反应发生条件——氧化性强的物质可以氧化还原性强的物质;还原性强的物质可以还原氧化性强的物质。日常生活中常用到铁皮,为了防止被腐蚀,常常镀上一层锌(白铁皮)或镀上一层锡(马口铁)。一旦镀层有破损以后,哪种铁皮先被腐蚀?理由?金属被腐蚀→被氧化→失电子能力→还原性,白铁皮中锌还原性强,先被氧化,铁皮依然得到了保护;而马口铁中,铁较锡还原性强,更易被腐蚀。结束氧化还原反应一般规律之三:氧化还原反应一般规律之三:反应发生的先后顺序—一般地,氧化剂总是先氧化还原性强的还原剂;还原剂总是先还原氧化性强的氧化剂。能否用浓硫酸干燥H2S气体?理由?SO2气体呢?从化合价角度考虑氧化还原反应一般规律之四:氧化还原反应一般规律之四:不同物质中,同一元素的不同价态发生变化时,该元素的化合价变化规律是:“只靠拢,不交叉”。结束2.0.3molCu2S与足量的硝酸反应,生成硝酸铜、硫酸、一氧化氮和水,则参加反应的硝酸中被还原的硝酸的物质的量为()A.0.9molB.1molC.1.2molD.2.2mol练习巩固B分析:未被还原的硝酸以Cu(NO3)2形式存在,共有0.6molCu,故未被还原的硝酸有0.6×2=1.2mol未被还原的硝酸的物质的量呢?继续巧解根据得失电子守恒,失电子总数=0.3×(2+8)=3mol,故硝酸被还原成NO共1mol。结束根据金属性、非金属性强弱来判断氧化性、还原性强弱比较氧化性、还原性强弱比较K+…、Al3+(H+)…Zn2+…H+、Cu2+【应用】电解池反应中阴极的放电顺序如何排列?放电(得电子)能力增强与金属活动性顺序相反方法2结束金属单质的还原性随金属性增强而增强,其离子的氧化性相应减弱非金属单质的氧化性随非金属性增强而增强,其离子的还原性相应减弱结束已知:5PbO2+4H++2Mn2+=5Pb2++2MnO4-+2H2O根据方程式判断氧化性强弱。对于任何氧化还原反应,都满足下列规律:强氧化剂+强还原剂=弱还原剂+弱氧化剂ABba氧化性:A>a还原性:B>b氧化性:PbO2>MnO4-结束判断氧化性强弱:Fe3+与Fe2+KMnO4与MnO2;还原性强弱:S2-、S与SO3氧化性:Fe3+>Fe2+KMnO4>MnO2;还原性:S2->S>SO3氧化性、还原性强弱比较方法之三氧化性、还原性强弱比较方法之三::从元素化合价高低来判断:从元素化合价高低来判断:一般地说,同一种变价一般地说,同一种变价元素的几种物质,它们的氧化能力是由高价态到低元素的几种物质,它们的氧化能力是由高价态到低价态逐渐减弱,还原能力则依次逐渐增强。价态逐渐减弱,还原能力则依次逐渐增强。★特殊性:氧化、还原能力还与物质的稳定性、温度、浓度、酸碱性等有关。如:氧化性HClO>HClO4;H2SO3>H2SO4(稀)KMnO4氧化性:酸性>中性>碱性结束想一想是否还有其它的方法可用来比较氧化性、还原性强弱?试举例说明。氯气、硫分别与铁反应钠、镁、铝分别与水反应电极反应(原电池、电解池)反应产物反应条件结束课堂小结氧化还原反应氧化还原反应反应实质表现特征一般规律强弱比较1.得失电子守恒2.强强氧化剂+强强还原剂=弱弱还原剂+弱弱氧化剂3.反应顺序:先强后弱4.同一元素不同价态反应,化合价变化规律:““只靠拢,不交叉”只靠拢,不交叉”1.金属性、非金属性强弱2.根据反应规律(2)3.同种元素主要看化合价高低4.其它结束综合应用1.判断下列反应能否发生?若能发生,如何设计简易实验检验反应产物?同时写出离子反应方程式,并比较氧化性强弱。☆2Fe3++2I-=2Fe2++I2☆2Fe2++Br2=2Fe3++2Br-☆MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O氧化性:Br2>Fe3+MnO4->Fe3+>I2氧化性:MnO4->MnO2>Cl2>Br2>Fe3+>I2☆KI溶液滴入FeCl3溶液中☆Br2水滴入FeSO4溶液中☆KMnO4溶液和FeSO4溶液混合结束综合应用2.根据上述实验,试写出少量氯水和足量氯水分别与FeBr2溶液反应的离子方程式。☆①2I-+Cl2=I2+2Cl-②Cl2+2Fe2+=2Cl-+2Fe3+☆①Cl2+2Fe2+=2Cl-+2Fe3+②2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-替换试用离子方程式表示将氯水逐滴加入FeI2溶液中的反应过程。☆①Cl2+2Fe2+=2Cl-+2Fe3+②2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-?结束亚硝酸钠(NaNO2)可用做水泥施工的抗冻剂。它易溶于水,有咸味,既有氧化性,又有还原性。在酸性溶液中它能氧化I-和Fe2+。它能将人体内血红蛋白里所含的Fe2+氧化为Fe3+使人中毒,在建筑工地上曾多次发生将亚硝酸钠误作食盐食用,导致民工中毒的事件。亚硝酸钠和酸反应生成亚硝酸,亚硝酸是不稳定的弱酸,它只存在于冷的稀溶液中,易发生如下分解反应:3HNO2=2NO↑+HNO3+H2O。从浓醋酸、氨水、纯碱、稀盐酸、KI-淀粉溶液中选择适当的物质做试剂,用两种简单的化学实验鉴别亚硝酸钠和氯化钠。试写出两种实验方法使用的试剂和据以鉴别它们的现象。(其中方法一只能用一种试剂)综合应用二………………………………………………………………………………………………………………………………………………………稀冷结束方法一:(只用一种试剂)试剂:浓醋酸(或微热的稀盐酸)现象:放亚硝酸钠的试管上部出现红棕色有刺激性气味的气体,放氯化钠的试管无明显变化。方法二:试剂:稀盐酸、KI-淀粉溶液现象:放亚硝酸钠的试管溶液变蓝色,放氯化钠的试管无明显变化。参考答案结束



















